 최근 신의료기술 평가 신청건수와 평가기간이 늘어나고 있는 점을 감안해 향후 신의료기술 시장진입의 효율화를 도모해야 한다는 주장이 제기됐다.
최근 신의료기술 평가 신청건수와 평가기간이 늘어나고 있는 점을 감안해 향후 신의료기술 시장진입의 효율화를 도모해야 한다는 주장이 제기됐다.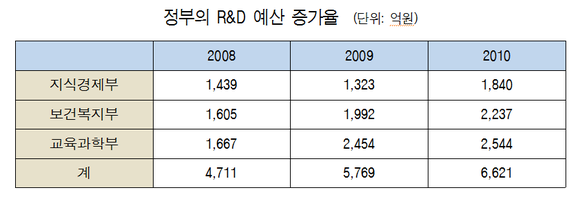
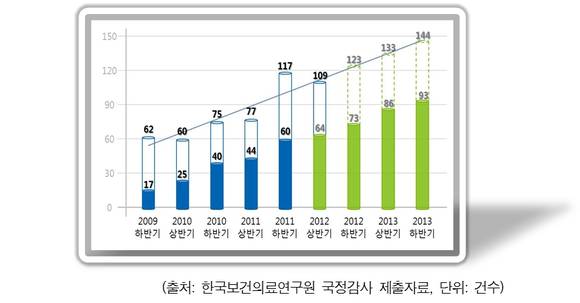
 이 의원은 "이처럼 보건연의 신의료기술 평가인증에 대한 수요가 점차 늘어남에 따라 향후 평가기간 단축을 통한 첨단 의료기술의 신속한 시장진입 및 전문화되는 신의료기술 평가를 위해 전문평가연구 인력의 확충과 평가의 효율화 방안 마련이 시급하다"고 강조했다.
이 의원은 "이처럼 보건연의 신의료기술 평가인증에 대한 수요가 점차 늘어남에 따라 향후 평가기간 단축을 통한 첨단 의료기술의 신속한 시장진입 및 전문화되는 신의료기술 평가를 위해 전문평가연구 인력의 확충과 평가의 효율화 방안 마련이 시급하다"고 강조했다.
 최근 신의료기술 평가 신청건수와 평가기간이 늘어나고 있는 점을 감안해 향후 신의료기술 시장진입의 효율화를 도모해야 한다는 주장이 제기됐다.
최근 신의료기술 평가 신청건수와 평가기간이 늘어나고 있는 점을 감안해 향후 신의료기술 시장진입의 효율화를 도모해야 한다는 주장이 제기됐다.

 이 의원은 "이처럼 보건연의 신의료기술 평가인증에 대한 수요가 점차 늘어남에 따라 향후 평가기간 단축을 통한 첨단 의료기술의 신속한 시장진입 및 전문화되는 신의료기술 평가를 위해 전문평가연구 인력의 확충과 평가의 효율화 방안 마련이 시급하다"고 강조했다.
이 의원은 "이처럼 보건연의 신의료기술 평가인증에 대한 수요가 점차 늘어남에 따라 향후 평가기간 단축을 통한 첨단 의료기술의 신속한 시장진입 및 전문화되는 신의료기술 평가를 위해 전문평가연구 인력의 확충과 평가의 효율화 방안 마련이 시급하다"고 강조했다.(주)뉴온미디어 | 발행인/편집인 : 황리현 | 등록번호 : 서울 아 01076 등록일자 : 2009.12.21 서울본사 : 서울시 영등포구 양평동4가 280-8(선유로 274) 3층 TEL. 02-2671-0203 FAX. 02-2671-0244 충북본부 : 충북본부 : 충북 충주시 신니면 신덕로 437 TEL.070-7728-7008 영남본부 : 김해시 봉황동 26-6번지 2층 TEL. 055-905-7730 FAX. 055-327-0139 ⓒ 2002 Foodtoday.or.kr. All rights reserved. 이 사이트는 개인정보 수집을 하지 않습니다. 푸드투데이의 모든 컨텐츠를 무단복제 사용할 경우에는 저작권법에 의해 제재를 받을 수 있습니다