[푸드투데이 = 황인선기자] 엔지켐생명과학(대표 손기영)은 COVID-19 폐렴 환자를 대상으로 진행한 국내 임상 2상 시험을 통해 회복기간(Time to Recovery) 관련 유의미한 결과와 사이토카인 폭풍 억제 관련 유의미한 결과를 얻었다고 지난 27일 공시를 통해 밝혔다.
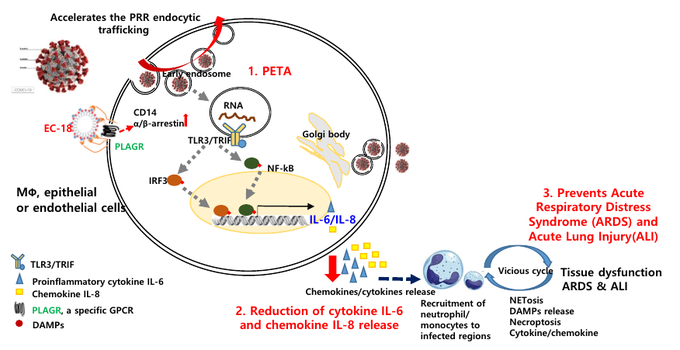
COVID-19 바이러스가 세포 내로 유입되면 endosome을 형성하고 TLR3에 의해서 IRF3와 NF-kB 가 활성화되고, IL-6와 IL-8의 분비를 증가시켜 사이토카인 폭풍이 일어나 조직 손상 및 급성 폐 손상이 초래된다. 엔지켐생명과학이 개발 중인 EC-18(모세디피모드)은 PETA(패턴인식수용체 세포내 재순환 촉진제) 작용기전을 통해 초기에 endosome에 의한 TLR3 dependent signal을 조절하여 바이러스로 인한 IL-6와 IL-8의 분비 감소를 통해 빠르고 신속하게 항상성을 회복시키는 First-in class 면역조절물질이며, 2020년 5월 국내에서 두번째 COVID-19 치료제로 식약처에서 임상 2상 시험 승인을 받았다.
엔지켐생명과학 관계자는 "COVID-19 폐렴의 병태생리에 핵심 역할을 하는 염증성 사이토카인 IL-8과 IL-6에서 통계적으로 유의미한 감소를 발견할 수 있었다. IL-8의 경우 시험 1일차에 비해 시험 14일에서 통계적으로 유의미한 감소(p=0.0032)를 나타냈으며, IL-6 또한 50~64세 연령군에서 시험 1일차에 비해 시험 14일차에서 통계적으로 유의미한 감소(p=0.0021)를 확인했다. 이러한 결과는 여러 선행 연구들과 일관되게 EC-18의 핵심 작용 기전인 면역조절 효과를 COVID-19 폐렴 환자에서도 확인했다는데 의의가 있다. 또한 대상자 증상의 호전을 보여주는 지표인 영국 조기경고 점수(NEWS)의 경우, 50~64세 연령군에서 Baseline 대비 투약 8일~14일까지 EC-18 투약군이 위약군보다 통계적으로 유의미하게 평균값이 감소된 것을 확인했다"고 밝혔다.
안전성에 있어서도 EC-18 투약 후 위약군과 비교했을 때, 대부분의 이상반응은 경증이었으며, 이상반응 발생빈도에서 시험군과 대조군에서 통계적 차이가 관찰되지 않았고, 활력징후와 심전도 등에서도 임상적으로 유의미한 이상반응은 관찰되지 않았다. 이와 같은 결과를 토대로 EC-18은 내약성과 안전성이 우수한 것을 확인했다.
국내 임상 2상에서는 탐색적 임상시험의 제한된 소수의 대상자 참여와 증상 악화 같은 이상반응 발생 시 투약을 즉시 중단하도록 설계된 임상 디자인의 한계로, 총 14일 동안 1일 1회 경구 투약을 통해 확인하고자 했던 1차 평가변수인 경증 폐렴 환자에서 14일 이내에 산소 치료가 필요한 중증 폐렴 또는 급성호흡곤란증후군(ARDS)으로 이행되는 확률(%)은 투약군 간 통계적 유의성을 확인하지 못했다.
엔지켐생명과학 관계자는 "이번 국내 임상 2상 시험을 통해 COVID-19 경증 폐렴 환자에서 표준치료와 EC-18 병행 투여시 IL-8, IL-6 감소를 통한 면역조절 효과 및 대상자 증상이 호전되는 양상과 COVID-19에 대한 EC-18의 PETA 작용기전이 적용됨을 확인할 수 있었다. 이를 근거로 대상자 회복기간(Time to recovery)을 주 평가지표로 하는 COVID-19 환자 대상 임상 2b/3상 시험을 진행하여 긍정적 결과를 도출할 수 있을 것으로 예상되므로, EC-18을 해외 임상 등 추가 임상시험을 통한 경구용 COVID-19 치료제로 개발 추진중에 있다"고 밝혔다.





















